盐酸
名称来源
英文中,盐酸有一个别名“muriatic acid”,意即“和食盐有关系的酸”,目前该名称也在使用 。盐酸的中文命名最早应追溯至1855年英国传教医师合信编写的《博物新编》。此书在上海出版,主要介绍西方近代的自然科学知识,其中提到了“盐强水”的制备方法及性质,此“盐强水”即盐酸。 而在19世纪傅兰雅、徐寿翻译的《化学鉴原》中,盐酸的命名是“氢绿” 。这段时间,对化学物质的命名种类繁多 ,一直到1932年《化学命名原则》的颁布才得以统一 。现行的1980年《中国化学会无机化学命名原则》中提到了盐酸及其别名氢氯酸 。
历史
王水是一种由盐酸与硝酸组成的混合物。13世纪欧洲炼金术士 伪贾比尔 ( 英语 : Pseudo-Geber ) 的作品中提到,可以通过将 卤砂 ( 英语 : sal ammoniac ) (主要成分为氯化铵)溶于硝酸来制备王水 。也有说法称最先在手稿中提到王水的是13世纪末的拜占庭 。
16世纪,利巴菲乌斯第一次正式记载了分离出的纯净盐酸,他是在粘土坩埚中加热盐与浓硫酸的混合物来制备它的 。也有一些作者认为纯的盐酸是由15世纪德国本笃会的 巴希尔·瓦伦丁 ( 英语 : Basil Valentine ) 制备的 ,他的方法是将食盐与硫酸亚铁混合加热后酸化 。不过,其他一些作者认为直到16世纪末都没有文献明确表明有人制备过纯的盐酸 。
17世纪,德国卡尔施塔特县的约翰·格劳勃通过 曼海姆法 ( 英语 : Mannheim process ) 加热氯化钠和硫酸来制备硫酸钠,并释放出了氯化氢气体。1772年英国利兹的约瑟夫·普利斯特里制出了纯的氯化氢气体 。1808年,英国彭赞斯的汉弗里·戴维证明了氯化氢气体由氢、氯两种元素组成 。
工业革命期间,欧洲对 碱 ( 英语 : alkaline ) 的需求有所增加。法国伊苏丹的尼古拉斯·勒布朗新发现了一种碳酸钠(苏打)工业制法,使碳酸钠得以大规模廉价生产。勒布朗制碱法用硫酸、石灰石、煤将食盐转变为苏打,同时生成副产物氯化氢气体。这些氯化氢大多排放到空气中,直到各国出台相关法规(例如英国《 1863年碱类法令 ( 英语 : Alkali Act 1863 ) 》)后,苏打生产商们才用水吸收氯化氢,使得盐酸在工业上大量生产。
20世纪,无盐酸副产物的氨碱法已经完全取代勒布朗法。这时盐酸已成为许多化工应用中很重要的一种化学品,因而人们开发了许多其他的制备方法,其中一些至今仍在使用。2000年后,绝大部分盐酸都是由工业生产有机物得到的副产品氯化氢溶于水而得到的。
1988年,因为盐酸常用于制备海洛因、可卡因、甲基苯丙胺等毒品,《联合国禁止非法贩运麻醉药品和精神药物公约》将其列入了表二-前体中 。
物理性质
盐酸的物理性质(如熔点、沸点、密度与pH等)取决于其溶质氯化氢的浓度或摩尔浓度。氯化氢的质量分数范围为接近0%(极稀的溶液)到超过40%(发烟盐酸)。
如下左图所示,盐酸共有四个结晶的共熔点,分别对应四种晶体:68%(HCl的质量分数,下同)时的HCl·H 2 O、51%时的HCl·2H 2 O、41%时的HCl·3H 2 O和25%时的HCl·6H 2 O。另外在24.8%时还有一种亚稳的HCl·3H 2 O生成。
盐酸在一定压力下能形成共沸溶液。下右图为一个大气压下不同浓度盐酸的沸点,其中下方的线与上方的线分别表示相应温度下,液体及与液体处于平衡状态的蒸气的组分。氯化氢的质量分数20.24%对应最高沸点108.6℃。
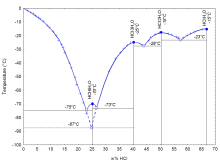
盐酸的熔点关于水溶液中氯化氢质量分数的关系图
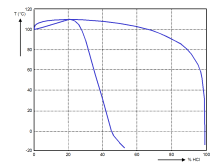
盐酸的沸点关于水溶液中氯化氢质量分数的关系图
制备
盐酸主要由氯化氢溶于水来制备 。而氯化氢又有多种制备的方式,所以有许多前体。另外,也可以通过氯气与二氧化硫在水溶液中作用来制备:
用重水水解氯化物(如三氯化磷、二氯亚砜等)或酰氯,可以得到含有氘的盐酸:
工业制备
盐酸的大规模生产已经与其他化学品的工业生产流程相结合,形成了一个较完备的体系。如上所述,要制备盐酸,通常先制备氯化氢。工业制备氯化氢主要使用以下方法:
直接化合,在氯碱工业中,通过电解饱和的氯化钠溶液而获得的氢气按比例置于氯气中燃烧,发生以下链式反应:
用食盐与浓硫酸在加热条件下作用 :
其他反应的副产物产生氯化氢,例如烃类的氯化,或有机氯化合物的脱卤反应等 :
工业生产的盐酸浓度通常为37%,常因含有杂质FeCl 3 而显黄色 。40%以上的更高浓度在化学上可以实现,但其蒸发速率太快,导致储存与处理时都需要采取额外的措施,例如低温、加压等。工业大量需求的浓度是30%到34%,此时氯化氢蒸气损耗最少,是运输时的最佳浓度。在美国,一般商业出售的盐酸浓度介于20%到32%之间;家用盐酸(用于清洁等)浓度在10%到12%,且推荐在使用前稀释数倍。英国家用盐酸浓度与美国的工业级相同。 中国工业用盐酸浓度为31%或更低,主要由氯碱、化肥企业生产 。
世界上生产盐酸最多的公司是陶氏化工,若计入氯化氢气体,其产量约为每年两百万吨(2Mt/a)。另外, 乔治亚海湾公司 ( 英语 : Georgia Gulf ) 、 东曹株式会社 ( 英语 : Tosoh ) 、阿克苏诺贝尔与泰森德洛的产量分别为0.5-1.5Mt/a。据估计,世界的总产量为20Mt/a,其中3Mt/a由直接合成得到,剩下的都是有机反应等得到的副产物。迄今为止,大部分的盐酸都由生产者自己使用,而在世界市场上流通的大约只有5Mt/a。
化学性质与反应

盐酸是常用的实验室试剂
盐酸是一种一元酸,这意味着它只能电离出一个H +。在水溶液中,H 与一个水分子络合,成为H 3 O +:
可以看出,电离后生成的阴离子是Cl −,所以盐酸可以用于制备氯化物,例如氯化钠。盐酸是强酸,在水中能够完全电离。
一元酸只有一个酸离解常数,符号为 K a 。它能够度量水溶液中酸的强度。于盐酸等强酸而言, K a 很大,只能通过理论计算来求得 。向盐酸溶液中加入氯化物(比如NaCl)时pH基本不变,这是因为Cl 是盐酸的共轭碱,强度极弱。所以在计算时,若不考虑极稀的溶液,可以假设H 的物质的量浓度与原氯化氢浓度相同。如此做即使精确到四位有效数字都不会有误差。
盐酸具有还原性,可以和一些强氧化剂反应,放出氯气 :
一些有氧化性的碱和盐酸可以发生氧化还原反应,而不是简单的中和反应 :
配位化学
部分金属化合物溶于盐酸后,金属离子会与氯离子络合。例如难溶于冷水的二氯化铅可溶于盐酸:
铜在无空气时难溶于稀盐酸,但其能溶于热浓盐酸中,放出氢气:
分析化学
在分析化学中,用酸来测定碱的浓度时,一般都用盐酸来滴定。用强酸滴定可使终点更明显,从而得到的结果更精确。在1标准大气压下,20.2%的盐酸可组成共沸溶液,常用作一定气压下定量分析中的基准物。其共沸时的浓度会随着气压的改变而改变。
盐酸也常用于溶解固体样品以便进一步分析。稀盐酸能够溶解许多金属(金属活动性排在氢之前的),生成金属氯化物与氢气:
或者与碳酸钙或氧化铜反应生成易溶的物质以便分析。
铜、银、金等活动性在氢之后的金属不能与稀盐酸反应,但铜在有空气存在时,可以缓慢溶解 :
有机化学
胺类化合物通常在水中溶解度不大。欲增大其溶解度,可以用稀盐酸处理为铵盐:
胺的盐酸盐属于离子化合物,根据相似相溶原理,在水中的溶解度较大。铵盐遇到强碱即可变回为胺:
利用这样的性质,可以将胺与其他有机化合物分离 。
此外,胺的盐酸盐的熔点或分解点可以用来测定胺的种类 。
锌粒与氯化汞在稀盐酸中反应可以制得锌汞齐,后者与浓盐酸、醛或酮一起回流可将醛酮的羰基还原为亚甲基,是为克莱门森还原反应 :
但应注意,此法只适用于对酸稳定的化合物,α、β-碳碳双键等也会被还原 。
浓盐酸与无水氯化锌混合可以制得卢卡斯试剂,用来鉴别六碳及以下的醇是伯醇、仲醇还是叔醇 。
酸碱中和
盐酸还可以与氢氧化钠混合,产生食盐:
应用
盐酸是一种无机强酸,在工业加工中有着广泛的应用,例如金属的精炼。盐酸往往能够决定产品的质量。
酸洗钢材
盐酸一个最重要的用途是酸洗钢材。在后续处理铁或钢材(挤压、轧制、镀锌等)之前,可用盐酸反应掉表面的锈或铁氧化物 。通常使用浓度为18%的盐酸溶液作为酸洗剂来碳钢:
剩余的废酸常再用作氯化亚铁溶液,但其中重金属含量较高,故这种做法已经逐渐变少。
酸洗钢材工业发展了 盐酸再生 ( 英语 : hydrochloric acid regeneration ) 工艺,如喷雾焙烧炉或流化床盐酸再生工艺等。这些工艺能让氯化氢气体从酸洗液中再生。其中最常见的是高温水解工艺,其反应方程式如下:
将制得的氯化氢气体溶于水即又得到盐酸。通过对废酸的回收,人们建立了一个封闭的酸循环 。副产品氧化铁在各种工业加工流程中也有较多应用 。
制备有机化合物
盐酸的另一大主要用途是制备有机化合物,例如合成PVC塑料的原料氯乙烯、二氯乙烷、聚碳酸酯的前体双酚A、催化胶黏剂聚乙烯醇缩甲醛 、抗坏血酸等。企业合成PVC时通常不用市售的,而使用内部制备的盐酸。盐酸在制药方面也有很大的用途。
制备无机化合物
盐酸可以发生酸碱反应,故能制备许多无机化合物,例如处理水所需的化学品氯化铁与聚合氯化铝(简称聚铝,PAC):
氯化铁与聚铝在污水处理、纸、饮用水等的生产中起絮凝剂和混凝剂的作用 。
用盐酸还可以制备其他的无机物,包括道路用盐氯化钙、电镀用盐氯化镍、镀锌工业和电池制造业用盐氯化锌等。 另外,常通过氯化锌活化法从木炭制备活性炭 。
控制pH及中和碱液
盐酸可以用来调节溶液的pH值:
在工业中对纯度的要求极高时(如用于食品、制药及饮用水等),常用高纯的盐酸来调节水流的pH;要求相对不高时,工业纯的盐酸已足以中和废水,或处理游泳池中的水 。
阳离子交换树脂的再生
高质量的盐酸常用于阳离子交换树脂的再生。阳离子交换广泛用于矿泉水生产中,除去溶液中含有的Na 、Ca 等离子,而盐酸可以冲掉反应后树脂中的这些离子。 一个H 替换一个Na ,Ca 则需要两个H 。
离子交换树脂和软化水在几乎所有的化学工业中都有应用,尤其是饮用水生产和食品工业 。
其他应用
盐酸还有许多小规模的用途,比如皮革加工、食盐生产、家务用清洁剂 ,以及用于建筑业 。石油工业也常用盐酸:将盐酸注入油井中以溶解岩石,形成一个巨大的空洞。此法在北海油田的石油开采工业中经常用到。
盐酸可以溶解碳酸钙,其应用包括除水垢或砌砖使用的石灰砂浆 ,但盐酸较为危险,使用时需谨慎。它与石灰砂浆中的碳酸钙反应生成氯化钙、二氧化碳和水:
在明胶、食品、食品原料和食品添加剂的生产中常用到盐酸。典型例子有阿斯巴甜、果糖、柠檬酸、赖氨酸、酸水解植物蛋白等。这些工艺都使用食品级(非常纯)的盐酸。
在生物体中的存在
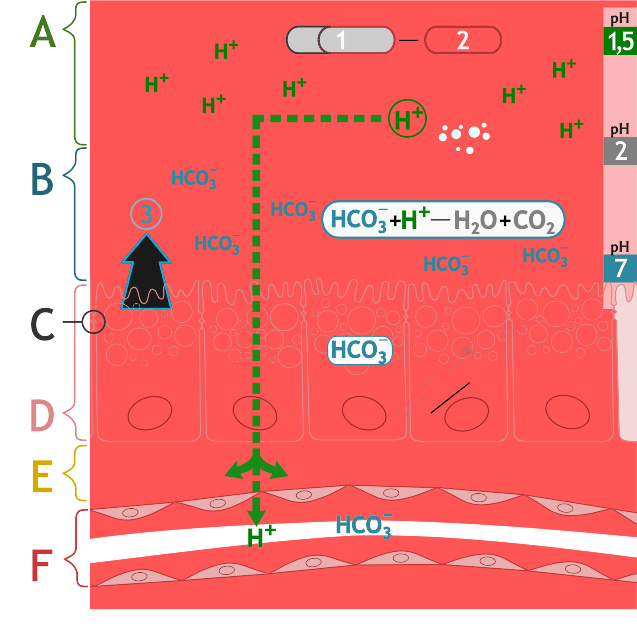
图为胃的粘膜层,并解释了胃的粘膜防御作用的机制
胃酸是胃的主要分泌物。胃酸主要由盐酸组成,其pH大约为1-2。
氯离子(Cl )和氢离子(H )由壁细胞分泌。壁细胞位于 胃粘膜 ( 英语 : gastric mucosa ) 上,胃粘膜又在胃的顶部区域,即胃底。壁细胞中含有大量分泌小管,两种离子在其中结合,之后进入胃腔。
胃酸是抵御微生物感染的屏障,对食物的消化也很重要。胃酸较低的pH使蛋白质变性,让其易为消化酶中的胃蛋白酶所水解。低pH也能促使酶前体胃蛋白酶原自我切割活化为胃蛋白酶。食糜离开胃部进入十二指肠以后,其中所含的盐酸便被十二指肠中的碳酸氢钠中和。
胃能够保护自己不被强酸腐蚀,这是因为它分泌了一层很厚的黏液,且胰腺在促胰液素的作用下会产生含碳酸氢钠的胰液来缓冲,这样的机制称为粘液-碳酸氢盐屏障。如果没有这些机制,可能会出现胃或胃及十二指肠溃疡等症状。这样的情况下,可使用抗组胺药及质子泵抑制剂等药物抑制胃酸的生成,或者服用抗酸药来中和胃酸。
安全性
浓盐酸(发烟盐酸)会挥发出酸雾。盐酸本身和酸雾都会腐蚀人体组织,可能会不可逆地损伤呼吸器官、眼部、皮肤和胃肠等 。在将盐酸与氧化剂(例如漂白剂次氯酸钠或高锰酸钾等)混合时,会产生有毒气体氯气。
人们常穿戴 个人防护装备 ( 英语 : Personal protective equipment ) 来减少处理盐酸带来的危害,包括乳胶手套 、护目镜、耐腐蚀的服装与鞋等。美国国家环境保护局已将盐酸定为有毒物质。
氯化氢的危险性取决于其浓度。下表中列出了欧盟对盐酸溶液的分类。
盐酸的联合国危险货物编号是1789,在装它的容器上需要注明这个编号 。
参见
氯化物
王水
注释
^ 此处"air"即“气体”。
^ muriatic acid gas即氯化氢气体
^ 即氯化钾
^ 反应方程式为: 2 H C l + 2 K → → --> 2 K C l + H 2 {\displaystyle {\rm {2HCl+2K\rightarrow 2KCl+H_{2}}}}
^ “con.”表示浓,下同
^ “rt”即室温
(英文) EPA Hazard Summary
(英文) Hydrochloric acid MSDS by Georgia Institute of Technology
(英文) NIOSH Pocket Guide to Chemical Hazards
(英文) National Pollutant Inventory – Hydrochloric Acid Fact Sheet
(简体中文) 关于做好易制毒化学品生产使用环境监管及无害化销毁工作的通知
(繁体中文) 光电材料及元件制造业空气污染管制及排放标准
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

相关资料

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
知识互答
关于我们

APP下载




























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}