锔
历史

格伦·西奥多·西博格

伯克利加州大学劳伦斯伯克利国家实验室的1.5米直径回旋加速器,摄于1939年8月
虽然过去的核反应实验中很可能已经产生了锔元素,但是要直到1944年,伯克利加州大学的格伦·西奥多·西博格、拉尔夫·A·詹姆斯(Ralph A. James)和阿伯特·吉奥索等人才首次专门合成并分离出锔。他们的实验使用了1.5米直径回旋加速器。
锔的化学辨认是在芝加哥大学的冶金实验室(现阿贡国家实验室)进行的。它是第三个被发现的超铀元素,但在元素周期表中却是第四个超铀元素(当时仍未发现镅)。
锔的合成过程如下:首先将硝酸钚溶液涂在面积约为0.5 cm 的铂薄片上,蒸发后的残留物经退火转换为二氧化钚(PuO 2 )。二氧化钚在回旋加速器中受照射之后,产物溶于硝酸中,再用浓氨水沉淀为氢氧化物。沉淀物溶于高氯酸,再用离子交换分离出锔的某个同位素。由于锔的分离过程十分繁复,以致发现团队最初称其为Pandemonium(希腊文中意为“群魔殿”或“地狱”)。
1944年7至8月, Pu经α粒子撞击后,产生了锔-242同位素,并释放了一颗中子:
科学家根据衰变时释放的α粒子的特征能量,确切地辨认了锔-242:
这条α衰变的半衰期最初测得为150天,后改为162.8天。
1945年3月进行的另一条反应又产生了 Cm同位素:
该同位素的α衰变半衰期为26.7。
锔和镅在1944年的发现与当时旨在制造原子弹的曼哈顿计划息息相关。有关其发现的信息一直保密到1945年才公诸于世。在1945年11月11日美国化学学会正式发布锔和镅的发现前5天,美国电台节目“Quiz Kids”(小朋友问答)的一位听众问到,战时除了镎和钚之外还有没有发现其他新的超铀元素,格伦·西博格回应时泄露了有关发现锔和镅的消息。

玛丽·居里(左)和皮埃尔·居里(右)
锔是以玛丽·居里(Marie Curie)和其丈夫皮埃尔·居里(Pierre Curie)命名的。两人发现了镭元素,并对放射性作出了相当的贡献。这种命名方法参照了元素周期表中位于锔以上的镧系元素钆:钆是以研究稀土元素的科学家、工程师 约翰·加多林 ( 英语 : Johan Gadolin ) 命名的。
最初制成的锔样本数量很少,肉眼仅仅可见。科学家利用其放射特性,辨认出锔元素。Louis Werner和Isadore Perlman在1947年于加州大学对镅-241进行中子撞击,首次制备了重30 µg的可观量氢氧化锔-242。 W. W. T. Crane、J. C. Wallmann和B. B. Cunningham在1950年制成了宏观量的氟化锔,其磁性和GdF 3 相似。这首次提供了实验证据,证明锔在其化合物中具+3氧化态。 1951年,科学家用钡还原氟化锔,唯一一次制成了金属态的锔。
特性
物理特性
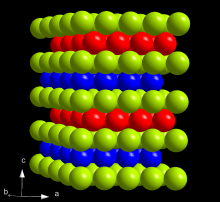
α型锔金属的双六方密排晶体结构,层序为ABAC(A:绿色,B:蓝色,C:红)

三(氢三)吡唑基硼酸根锔(III)配合物中Cm 离子经波长为396.6 nm的光照射后,发出橙色的萤光。
锔是一种放射性人工合成元素,也是质地坚硬、密度高的银白色金属。其物理和化学特性与钆相似。锔的熔点为1340 °C,这比前面的超铀元素镎(637 °C)、钚(639 °C)和镅(1173 °C)都要高,而钆的熔点则在1312 °C。锔的沸点为3110 °C,密度为13.52 g/cm 。这比镎(20.45 g/cm )和钚(19.8 g/cm )的密度低,但仍比大部分金属高。锔的两种晶体结构中,α型在标准温度和压力下更稳定。其具有六方对称结构,空间群为P6 3 /mmc,晶格参数 a = 365pm, c = 1182 pm,且每晶胞含四个化学式单位。 该晶体具有双六方密排结构,层序为ABAC,并和α镧同型。在23GPa压力以上及室温下,α锔会转变为β锔。β型具有面心立方对称结构,空间群为Fm 3 m,晶格常数 a = 493 pm。 进一步加压到43 GPa后,锔会变为属于正交晶系的γ锔结构,与α铀同型,并一直到52 GPa都不会再有相变。这三种锔的相态也被称为Cm I、II和III。
锔的磁特性奇特。其旁边的锕元素在不同温度下都不会偏离居里外斯顺磁性,但α锔会在冷却至65至52 K时转变为反铁磁性, 而β锔在大约205 K时转变成亚铁磁性。另外,锔和氮族元素的化合物在冷却后会转成铁磁性: CmN和 CmAs于109 K, CmP于73 K, CmSb于162 K。锔的镧系同系物钆以及钆的氮族元素化合物也会在冷却时转变磁性,但稍有不同:Gd和GdN变为铁磁性,而GdP、GdAs和GdSb则具反铁磁性。
锔的电阻率会随温度而变化:在4至60 K时大约翻倍,并从60 K到室温几乎保持恒等。由于其释放的α辐射会破坏自身的晶体结构,因此其电阻率会随时间快速提高,约10 µOhm·cm/h。故此很难确定锔的绝对电阻率(约125 µΩ·cm)。锔的电阻率与钆、钚和镎相近,但比镅、铀、钋和钍高出许多。
在紫外线照射下,锔(III)离子会发出强烈且稳定的橘黄色萤光,极值位于590至640 nm区间内,随环境条件而变化。 这种萤光特性是来自第一激发态 D 7/2 与基态 S 7/2 之间的转变。通过分析发出的萤光,可以监测有机及无机配合物中Cm(III)离子间的交互作用。
化学特性
锔的最稳定氧化态为+3,其离子在溶液中也具有+3态。 其+4态只出现在少有的几个固态化合物中,如CmO 2 和CmF 4 。 锔的化学特性与同为锕系元素的钍和铀不同,但和镅及许多镧系元素相似。在水溶液中,Cm 离子可以是无色或浅绿色的, 而Cm 离子则是浅黄色的。 Cm 的吸收光谱在375.4、381.2和396.5纳米波长处有尖锐的峰值,这些峰值的强度可以直接用来测量该离子的浓度。 锔离子属于硬酸,因此可以和硬碱产生最稳定的配合物。 两者间形成的主要为离子键,但含少量共价键的部分。 配合物中的锔主要以三帽三角菱柱形配位。
同位素
锔约有20种放射性同位素及7种同核异构体,质量数从233到252不等。这些同位素都具有放射性,其中半衰期最长的有 Cm(1560万年)和 Cm(348,000年);其他长半衰期的同位素包括 Cm(8500年)、 Cm(8,300年)和 Cm(4,760年)。锔-250较为特殊,主要以自发裂变的形式衰变(86%概率)。最常用的锔同位素为 Cm和 Cm,半衰期分别为162.8天和18.1年。

轻水反应堆(LWR)中 Pu和 Cm间的衍变图。 裂变百分比是100减去图中百分比。核素间的总衍变率有很大的差异。 Cm至 Cm的半衰期都很长,其衰变可忽略不计。
所有 Cm和 Cm之间的同位素,以及 Cm,都可以维持核连锁反应,因此理论上能在反应堆中作核燃料之用。正如多数超铀元素一样,质量数为奇数的锔同位素 Cm、 Cm和 Cm的核裂变截面特别高,都可以被用在热中子反应堆中。然而,所有锔同位素的混合物则只能用于快中子增殖反应堆中,因为质量数为偶数的锔同位素在热中子反应堆中不会裂变,并会随燃烧度的提高而累积。 当在发电反应堆中使用混合氧化物(MOX)燃料时,该燃料不应含有锔元素。这是因为中子活化会使 Cm变为锎,而锎是一种强中子射源,除了会污染核燃料循环的后部,还会对反应堆操作人员造成过量辐射的危险。因此,若要使用次锕系元素(铀和钚以外的锕系元素)作为热中子反应堆中的核燃料,则应从燃料中完全移除锔元素,或将锔置于特殊的燃料柱中作为燃料中的唯一一种锕系元素。
右表列出锔同位素做成球体,且不使用减速剂或反射器时的临界质量。如加上金属反射器(厚30 cm的钢铁),则奇数同位素的临界质量大约为3至4 kg。如使用水(厚度约20至30 cm)作为反射器,则临界质量可以大大下降: Cm可降至59克, Cm为155克,而 Cm为1550克。这些数值具有很高的不确定度。
由于产量稀少,造价昂贵,目前锔并没有被用作核燃料。 Cm和 Cm的临界质量很小,理论上可用于制造便携核武器,但至今没有相关的报导。锔-243的半衰期很短,会产生过量热量,因此不可用于核武器中。 锔-247的半衰期是钚-239的647倍,因此很适合用来制造核武器。
存量

“常春藤麦克”核试验的辐射落尘中探测到几种锔同位素。
锔-247是锔同位素中半衰期最长的,有1560万年。因此,所有原始的锔元素,也就是在地球形成时可能存在的锔,至今都已全部衰变殆尽。锔出现在乏核燃料中,其余则是通过人工制造的,主要用于科学研究。1945至1980年大气层核试验的进行地点存有一定的锔元素。 美国第一颗氢弹“常春藤麦克”(1952年11月1日于埃内韦塔克环礁引爆)的辐射落尘中,除了含有锿、镄、钚和镅之外,还有锫、锎和锔的一些同位素,其中包括 Cm、 Cm及更少量的 Cm、 Cm和 Cm。由于正值冷战时期,这些结果起初被列为军事机密,到1956年才正式公布。
大气层中的锔化合物较难溶于常见的溶剂中,但会黏附在泥土粒子上。分析表明,沙粒表面上的含锔量比其周围的水高出大约4,000倍;壤土中该比例甚至可高达18,000倍。
含铀量极高的矿藏中,重元素经中子捕获和β衰变之后,可形成几颗锔原子。
合成
同位素的制备
锔是在核反应堆中少量产生的。到目前为止, Cm和 Cm的总产量只有几公斤,其余更重的同位素只有数克或甚至数毫克的总产量。故此锔的价格昂贵,每毫克160至185美元; 更近期的估价为: Cm每克2,000美元, Cm每克170美元。 在反应堆中, U可以通过一系列的核反应形成锔。首先 U捕获一颗中子,变为 U,再经β – 衰变形成 Np和 Pu。
进一步捕获中子并进行β 衰变后,样本会变为 Am,再转换为 Cm:
实际研究在制造锔的时候,并不对铀进行照射,而是用钚。乏核燃料中含有大量的钚,能够轻易地提取使用。如果使用高中子通量的辐射,能通过另一条反应链形成 Cm:
锔-244在释放α粒子后,会衰变成 Pu;同时它会吸收中子,产生少量更重的锔同位素。这些同位素包括 Cm和 Cm,由于半衰期很长,因此常被用于科学研究。不过,由于 Cm在热中子撞击下容易裂变,因此该同位素在热中子反应堆中的产率较低。 经中子捕获产生 Cm的可能性同样很低,因为中间产物 Cm的半衰期非常短(64分钟),并会经β 衰变成为锫的 Bk同位素。
以上一连串的(n,γ)反应会产生不同锔同位素的混合物。合成后的分离过程十分繁复,所以科学家一般选择性地合成特定锔同位素。由于半衰期很长,锔-248最常用于研究用途。该同位素最有效率的合成方法是通过锎-252的α衰变。因为 Cf具有长半衰期(2.65年),因此容易大量取得。每年通过这种方法产生的 Cm大约有35至50 mg,同位素纯度为97%。
另一种研究常用的同位素 Cm可经由 Cf的α衰变产生,而 Cf可由 Bk的β 衰变产生。
锔金属的制备
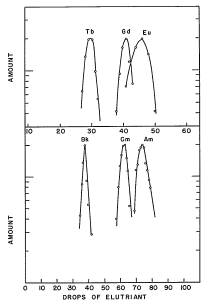
层析洗提曲线,能看出镧系的铽(Tb)、钆(Gd)和铕(Eu)与相应锕系的锫(Bk)、锔(Cm)和镅(Am)之间的相近之处。
一般的合成产物含有不同锔同位素的氧化物混合物。要分离出其中一种同位素,可以将乏核燃料(如混合氧化物核燃料)溶于硝酸中,再使用磷酸三丁酯和烃类的混合物,通过铀钚分离(PUREX)来萃取出大部分的铀和钚。然后利用二酰胺来萃取水溶残余物(残液)中剩余的镧系元素和锕系元素。产物将会是三价锕系及镧系元素的混合物。要分离出当中的锔化合物,可用多重步骤的层析法及离心法,并使用适当的试剂。 其中一种可用来专门提取锔的试剂为双三嗪基二吡啶配合物。 如要使锔从非常相似的镅中分离出来,可将两者氢氧化物的混合浆状物置于碳酸氢钠水溶液中,并在加热后加入臭氧。大部分的镅和锔在溶液中都具有+3价态。其中镅会被氧化,形成可溶的Am(IV)配合物,而锔则不会改变,故可再重复用离心法提取出来。
科学家通过对锔化合物进行还原反应来取得处于金属态的锔元素。其中一种可用于制备锔金属的化合物为三氟化锔。反应必须在不含水或氧的环境下进行,使用钽和钨造的器具,并以钡或锂作为还原剂。
另一可行方法是在氯化镁和氟化镁的熔化混合物中用镁锌合金来还原二氧化锔。
化合物及反应
参见:Category:锔化合物。
氧化物
锔会和氧迅速反应,主要形成Cm 2 O 3 和CmO 2 , 另也会形成二价氧化锔:CmO。 草酸锔(Cm 2 (C 2 O 4 ) 3 )、硝酸锔(Cm(NO 3 ) 3 )或氢氧化锔在纯氧中燃烧后可制成呈黑色的CmO 2 。 当在真空中(约0.01Pa压力下)加热到约600至650 °C度时,该氧化物会转变成呈白色的Cm 2 O 3 :
另一种制得Cm 2 O 3 的方法是使用氢气对CmO 2 进行还原反应:
其他已知的氧化物还包括诸如M(II)CmO 3 型的三元氧化物,其中的M表示任何一种二价金属,如钡。
卤化物
对含有三价锔离子的溶液注入氟离子,可产生无色的三氟化锔(CmF 3 )。呈棕色的四氟化锔(CmF 4 )则只能通过三氟化锔和氟气间的反应才能形成:
锔还可以形成A 7 Cm 6 F 31 型的三元氟化物,其中的A表示碱金属。
氢氧化锔(III)(Cm(OH) 3 )与无水氯化氢气体反应后,会形成无色的三氯化锔(CmCl 3 )。要制造其他的锔卤化物,可在约400至450 °C的高温下,使三氯化锔与对应的卤化铵盐反应。以此方法可制得三溴化锔(无色至浅绿色)及三碘化锔(无色):
另一种方法须把氧化锔和对应的酸一起加热到600 °C(比如,要制造溴化锔,则要使用氢溴酸)。 对三氯化锔进行气态水解后,会产生氯氧化锔:
氧族及氮族元素化合物
在高温下真空中使锔与气态硫、硒或碲反应,可分别制成锔的硫化物、硒化物和碲化物。 氮族的氮、磷、砷和锑可以和锔形成化学式为CmX的化合物。 要制造这些化合物,可在高温下使三氢化锔(CmH 3 )或金属锔与对应的氮族元素进行反应。
有机化合物
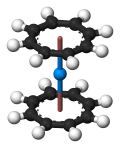
二茂锔的预测结构
钍、镤、镎、钚和镅等锕系元素都具有类似于二茂铀的金属有机配合物。分子轨道理论预测存在二茂锔配合物(η -C 8 H 8 ) 2 Cm,但至今仍待实验证明。
延伸X光吸收细微结构(EXAFS)已证实,在含有n-C 3 H 7 -BTP和Cm 离子的溶液中,存在Cm(n-C 3 H 7 -BTP) 3 型的配合物,其中BTP指2,6-二(1,2,4-三嗪-3-基)吡啶。某些BTP型配合物只和锔相互作用,因此在提取锔的过程中相当有用。 溶解了的Cm 离子会和许多有机化合物反应,包括异羟肟酸、 尿素、 萤光素、 和三磷酸腺苷等。 这些化合物都和各种微生物的内部活动相关。如此产生的配合物在紫外线的照射激发下,会发出强烈的橘黄色萤光。这不但使锔的探测过程更为方便,更可以通过观测半衰期的改变(约0.1毫秒数量级)及萤光光谱的变化,来研究Cm 离子与配体间的交互作用。
锔在生物体中没有已知的用途。 一些报告曾表明,细菌和古菌会吸附Cm 离子,但锔并没有掺入这些生物体内。
应用
放射性同位素

锔的放射性很强,在黑暗中会发出紫光。
锔是其中一种放射性最强的可分离元素。其两种最常见的同位素 Cm和 Cm都是强α粒子射源(能量为6 MeV),其半衰期相对较短,分别为162.8天和18.1年,每克所释放的功率分别为120瓦和3瓦。 因此氧化锔可被用于太空船中的放射性同位素热电机。科学家曾研究过如何用 Cm同位素发电,而 Cm则因价格昂贵(每克约2000美元)而不能使用。锔-243的半衰期约为30年,每克功率达到1.6瓦,故可用作燃料,但它的核衰变产物会释放大量有害的γ和β射线。 Cm所释放的α粒子无须大量辐射防护,但其自发裂变率很高,因此具有高中子辐射和γ辐射。相比同样用于放射性同位素热电机的 Pu, Cm释放的中子通量高出500倍;它释放强烈的γ射线,所需的辐射防护也高出20倍。功率为1 kW的样本需要约5 cm的铅作防护,而 Pu只需0.1 cm的铅。这样的应用在目前来说是不切实际的。
其中一项锔的实际应用是利用 Cm同位素来产生心律调节器中用于发电的 Pu。如不使用这种方法,则要通过 Np的(n,γ)反应,或用氘撞击铀,才能形成 Pu。这些过程都会产生 Pu,而这种副产品会衰变为释放大量γ辐射的 Tl,不适合加入心律调节器中。
科学家常使用锔来产生更重的超铀元素和超锕系元素。用氧( O )或镁( Mg )撞击 Cm,可以产生?( Sg)和?( Hs和 Hs)。 劳伦斯伯克利国家实验室用能量为35 MeV的α粒子撞击重数微克的锔-242,发现了锎元素:

火星探测器的α粒子X射线光谱仪
X射线光谱仪
同位素 Cm最实际的用途是在α粒子X射线光谱仪(APXS)中作α粒子射源,但可用体积有限。火星探路者、火星车、火星96、勇气号、火星探测漫游者、机遇号和火星科学实验室都使用了这种仪器来分析火星表面岩石的成分和结构。 测量员5至7号月球探测器也使用了APXS,但所用的α粒子源是 Cm。
APXS上装有一个传感器头,里面含有6个锔α粒子源,其总放射性衰变率为几十毫居里(约十亿贝可勒尔)。射源对准样本后,仪器就会分析从样本散射出来的α粒子和质子的能谱(只有某些光谱仪有分析质子的功能)。这些能谱包含有关所有主要元素量的信息(氢、氦和锂除外)。 罗塞塔号的菲莱登陆器(Philae Lander)也将用APXS来探测楚留莫夫-格拉希门克彗星的表面。
安全
由于具有放射性,锔必须在适当的实验室中用特殊的器材处理。锔元素本身主要释放α粒子,用很薄的普通材质就可以吸收阻挡。然而锔的一些衰变产物却会释放大量β及γ辐射,因此需要更加严密的保护措施。 一旦摄入体内,锔会在几天以内被排除体外,只剩余0.05%会吸收到血液内。血液中45%的锔会进入肝脏,45%进入骨骼,余下10%经排泄离开身体。骨骼中的锔会积累在与骨组织与骨髓的接触面上,而且不会随时间明显地分散。其辐射会破坏骨髓和其制造红血球的能力。锔的生物半衰期在肝脏中约为20年,而在骨骼中则为50年。 锔更容易通过呼入体内,其中 Cm在水溶态时的最高允许可摄入量为0.3 μC。 含 Cm和 Cm的溶液在经静脉注射进入老鼠的体内后,会导致其患上骨肿瘤的可能增大;经吸入后,则有可能造成肺癌和肝癌。
乏核燃料中不可避免地会含有锔同位素,大约每吨含20克锔。 其中 Cm至 Cm同位素的半衰期有数千年之久,必须先从要弃置的乏核燃料中分离出来。 锔分离出来后,要在反应堆中经中子撞击,成为短半衰期的核素。这种方法称为核转化,科学家目前正在研发锔的核转化过程。
书目
Greenwood, Norman N.; Earnshaw, Alan., Chemistry of the Elements 2nd, Oxford: Butterworth-Heinemann, 1997, ISBN 0080379419
Holleman, Arnold F.; Wiberg, Nils. Textbook of Inorganic Chemistry . Berlin: 102 Edition, de Gruyter. 2007. ISBN 978-3-11-017770-1.
Penneman, R. A.; Keenan, T. K.The radiochemistry of americium and curium. Los Alamos, California: Univsity of California. 1960.
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

相关资料

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
关于我们

APP下载




























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}