自由基
发展历史
历史上第一个被发现和证实的自由基是由摩西·冈伯格在1900年于密歇根大学发现的三苯甲基自由基。
历史上,词组“自由基”是用来命名作为连接分子的不同部分, 特别是当它们在反应过程中保持不变的时候。这些我们现在称为:官能团。比如,甲醇以前认为是由甲基“自由基”和羟基“自由基”所组成的。而甲醇在现在化学的理论中不认为具有自由基,它们既没有不成对的电子也没有活性的电子,因为它们(羟基和甲基)永远都是键合在一起的。但是在质谱当中我们则可以观察到在高能电子的轰击下,甲醇分子被断裂成羟基或者甲基的碎片自由基。
化学反应当中自由基的描述
在化学方程式当中,自由基最通常被表示为在原子或者分子式旁边的一个点,比如:
自由基反应机理使用单箭头来描述单电子的转移过程:
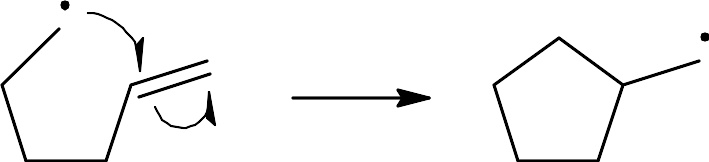
要断裂化学键的裂解,使用类似于鱼钩一样的单箭头(区分于成对电子的双箭头)来表述。这里要提示的是: 断开化学键的第二个电子也是和进攻自由基的单电子成对的, 而这里则不明确的表述出来。
自由基作为反应中间体参与了自由基加成反应和自由基取代反应。 含有自由基的链式反应可以通常被分割成三个不同的过程:“链引发”,“链增长”,“链终止”。
链引发阶段,反应中呈现自由基的净增长。它可以像反应1一样从稳定的形态来生成自由基,也可以是从自由基的形成反应当中来生成更多的自由基。
链增长阶段,反应当中生成了大量自由基,而自由基的总数量是保持不变的。
链终止阶段,反应总体呈现了自由基的净减少。两种自由基互相形成一种更稳定的物质, 比如:2Cl·→ Cl2
例如:甲烷和氯气取代反应的历程
链引发:氯分子在光的作用下,分解成两个氯原子(氯自由基)。从而引发反应
链增长:极活泼的Cl·夺取甲烷分子中的一个氢原子,生成甲基自由基(CH3·)和氯化氢。活泼的CH3·自由基立即再与氯分子反应,生成氯甲烷并生成一个新的自由基(Cl·)。该自由基又重新与CH4反应。如此反复循环,引起连锁反应。
链终止:当反应中的CH3Cl浓度增高,Cl·游离基将与CH3Cl生成CH2Cl·,并按上述类似过程生成CH2Cl2。进而生成CHCl3、CCl4等。当烷烃消耗完后,Cl·和其自身碰撞的机会增加,生成Cl2分子,其他自由基也可以相互结合生成稳定的分子,反应便告终止。
形成
自由基的形成可以是由于共价键的均裂,其过程需要较高的能量。比如一个H2分子转化为2H·需要 Δ Δ --> H ∘ ∘ --> = + 435 k J / m o l {\displaystyle \Delta \mathrm {H} ^{\circ }\mathrm {=} +\mathrm {435kJ} /\mathrm {mol} } 而一个Cl2分子转化为2Cl·需要 Δ Δ --> H ∘ ∘ --> = + 243 k J / m o l {\displaystyle \Delta \mathrm {H} ^{\circ }\mathrm {=} +\mathrm {243kJ} /\mathrm {mol} } 。这就是我们所说的键离解能, 它通常被简写为: Δ Δ --> H ∘ ∘ --> {\displaystyle \mathrm {\Delta {H}^{\circ }} } 。两个原子连接形成的共价键的键能是由整个分子的结构决定的,而并非仅仅与这两个原子有关。形成自由基其实需要更多的能量。化学键的均裂经常发生在两个具有相近电负性的原子之间。在有机化学当中经常是过氧化物当中的O-O键或者O-N键。有时候,由于附加的能垒,自由基的形成也可能是自旋禁阻的。
然而,链增长过程是一个非常剧烈的放热反应。这里需要注意的是,虽然自由基离子也是存在的,但是大多数的物质都是电中性的。
自由基还可以通过一个原子或者分子的氧化还原过程来形成。
燃烧
燃烧是最常见的自由基反应。氧分子是一种稳定的双自由基(可以表示为·O-O)。因为电子自旋平行,氧分子很稳定。当稳定基态氧分子(三线态氧)激发后,形成极度活泼的的单线态氧。为了使燃烧进行,必须跨越能垒。能垒的跨越需要较高的温度。三线态氧到单线态氧的转换是被“禁止的”。
聚合
除了燃烧反应以外,很多聚合反应都涉及自由基。很多塑料和其他聚合物都是由自由基聚合反应所形成。
大气中的自由基
参阅
自由基的命名法(C-081,C-082)
自由基名称表
化学捕捉
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
关于我们

APP下载



























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}