镤
历史
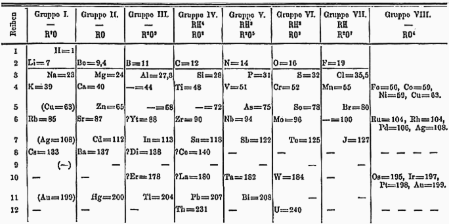
1869年门得列夫的周期表,钍和铀间预留一个空格。
1871年,门得列夫预测钍和铀之间有元素的存在。由于当时锕系元素还没有被发现,因此1950年代出版的周期表钽下面的空格是空的。这个情况造成很长一段时间的化学家都积极在寻找与钽相似的化性的元素,而使发现镤的概率趋近于零。
1900年,威廉·克鲁克斯将硝酸铀酰溶解于乙醚中,发现剩余的水中含有 Th和另一未知强烈放射性物质。他将它从硝酸铀酰分离,这个物质便是镤。但他不知道他发现了一个新的化学元素,并将其命名为铀-X。
镤真正首次发现于1913年,当时 法扬斯 ( 英语 : Kazimierz Fajans ) 和 奥斯瓦尔德·格林 ( 西班牙语 : Oswald Helmuth Göhring ) ,在他们的研究的铀-238衰变链( 铀→ 钍→ 镤→ 铀)中,发现了镤的同位素 镤。因为它的半衰期短只有6.7小时,所以他们将他们发现的新元素命名为 Brevium (拉丁语,意思是短暂、短期)。
1917年至1918年间,两组科学家奥托·哈恩和莉泽·迈特纳,以及德国和英国的弗雷德里克·索迪和约翰·克兰斯登(John Cranston)的,发现了镤的另一个同位素 镤,半衰期约32000年。因此,他们将名称从Brevium变更为镤(proto-actinium)(希腊文:πρῶτος,意义为之前,首先),因为镤在铀-235衰变链的位置在锕之前。
1927年, 阿里斯蒂德·冯·格罗斯 ( 英语 : Aristid von Grosse ) 提取出2毫克的五氧化二镤(Pa 2 O 5 ),并于1934年首次在0.1毫克的五氧化二镤中分离出纯镤。
1961年, 英国原子能管理局 ( 英语 : United Kingdom Atomic Energy Authority ) (UKAEA)花了50万美元处理了60吨的矿物,只提取出约125克纯度为99.9%镤,可见镤非常难取。
美国橡树岭国家实验室公布目前镤的成本约280美元/克。
生成

镤产生于沥青铀矿
镤是天然存在的最罕见和最昂贵元素之一。由于铀-235的α衰变(产生镤-231),以及铀-238的β衰变(产生镤-234),以至于镤通常是以 Pa和 Pa的形式存在。而几乎所有的铀238(99.8%)都会衰变成 Pa。
镤-233是钍-232中子俘获所形成的。而它会再衰变成铀-233,或者捕捉另一个中子,并转换成非裂变的铀-234。
镤出现在晶质铀矿(沥青铀矿)的浓度约0.3至3百万分浓度(ppm)。大部分的浓度为0.3ppm,但部分从刚果民主共和国产的矿物约有3ppm。在大多数的天然材料和在水中,镤以一兆分之一以下的浓度均匀分布,放射性约为0.1微居里/克。
制备
在核反应堆的出现之前,镤是从铀矿石用科学实验方法分离。如今,它主要是钍的高温反应器中的中间产物:
物理及化学性质
物理性质
镤是银灰色光泽的金属,可保存于空气中一段时间。
镤是周期表中位于铀的左侧;钍的右侧,而其物理性质正介于这两个锕系元素之间。镤的密度比钍大,而比铀轻;其熔点低于钍,而比铀高。这三个元素的热膨胀,电导率和导热程度互相媲美,是典型的“穷金属”。
估计镤的剪切模量类似钛。
在室温下,镤是体心四方结构,其可以被视为扭曲的体心立方晶格结晶;而这种结构在被压缩高达53 GPa时仍然不改变。 镤目前已知在任何温度下具有顺磁性而不会转变磁性。 在温度低于1.4K时将成为超导体。 在室温下镤四氯化碳是顺磁性的,而冷却至182K后会变成铁磁。
化学性质
镤容易与氧,水蒸气和酸反应,但不与碱金属反应。
无论是在固体和水溶液,镤存在两个主要的氧化态:+4和+5,而+3和+2的状态存在于一些固相。由于它的电子组态是[Rn]7s 6d 5f ,+5氧化态对应的低能量有利于5f 的电子填入。+4和+5都状态很容易在水中形成氢氧化物,主要离子包括Pa(OH) , Pa(OH) 2+ 2 , Pa(OH) + 3 a以及 Pa(OH) 4 ,皆无色。其他已知的离子包括 PaCl 2+ 2 , PaSO 2+ 4 , PaF , PaF 2+ 2 , PaF − 6 , PaF 2− 7 以及 PaF 3− 8 。
化合物
a,b和c是指每皮米的晶格常数,空间群编码和Z是每单位晶格的数目;fcc表示面心立方对称性。
同位素
目前已发现29个镤的同位素,其中最稳定的是 Pa,半衰期为32760年, Pa的半衰期为27天, Pa的半衰期为17.4天。其它的大部分都小于1.6天,其中的大部分又小于1.8秒。镤还有两个核异构体: Pa(半衰期 1.2毫秒)和 Pa(半衰期 1.17分)。
镤主要有两种衰变模式:变成较轻原子的α衰变 Pa( Pa 至 Pa)以及变成较重原子的β衰变( Pa 至 Pa)。 同位素镤 Pa主要的衰变产物为较轻的锕、较重的 Pa以及右的同位素。
注意事项
镤既有毒性,又有很高的放射性,因此须在一个密封的手套箱进行操作。
其主要的同位素 镤0.048居里/克,主要是发射α-粒子5 MeV,用薄的金属即可阻挡。 然后它会慢慢的衰变(半衰期为32760年)成 Ac, 能量为 74 居里/g,进行α和β衰变,半衰期为22年。接着会衰变成半衰期更短、能量更大的元素 , 其结果整理于下表:
镤是存在于自然界少量的天然元素,它是由食物或水摄入,或从空气吸入。 会存在于中的只会有0.05%,其余的会排出体外。其中的0.05%会进入骨骼, 有15%会进入肝脏,2% 进入肾脏,急于的再度离开身体。因此,在肝脏中的镤有70%的半衰期为10天,30%保持60天。肾脏的相应值分别为20%(10天)和80%(60天)。所有这些器官中,镤的放射性会促进肿瘤生成。 在人体内的 Pa最大安全剂量是0.03 微居里,相当于0.5微克,这种同位素是氢氰酸毒性的2.5 × 10 倍。 Pa 在空气中的最大存在量为 3×10 Bq/m .
锕系元素
免责声明:以上内容版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。感谢每一位辛勤著写的作者,感谢每一位的分享。

- 有价值
- 一般般
- 没价值








24小时热门
推荐阅读
关于我们

APP下载



























{{item.time}} {{item.replyListShow ? '收起' : '展开'}}评论 {{curReplyId == item.id ? '取消回复' : '回复'}}